Desperdicio de Paxlovid: 138,000 tratamientos sin usar en México
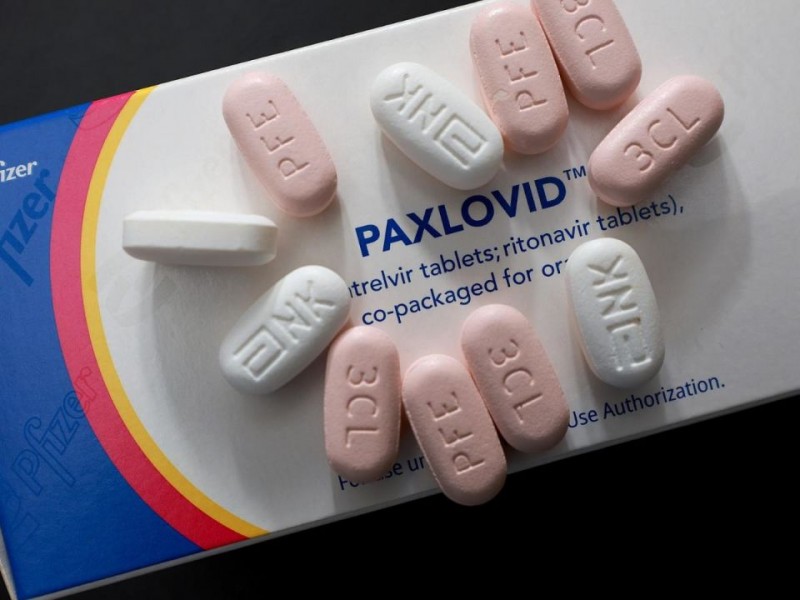
Paxlovid es un medicamento antiviral empleado en el tratamiento de la COVID-19 en adultos que no requieren oxígeno suplementario y que tienen un alto riesgo de progresar a una forma grave de la enfermedad.
En julio de 2022, las autoridades sanitarias de México firmaron un acuerdo con Pfizer para la adquisición de 300,000 tratamientos de Paxlovid por un total de 1,533 millones de pesos. Sin embargo, cifras oficiales de la Secretaría de Salud revelaron que la distribución de estos tratamientos fue limitada entre septiembre y diciembre de ese año, y no satisfizo las necesidades médicas en ese momento.
De los tratamientos adquiridos, al menos 138,000 se desperdiciaron. A pesar de contar inicialmente con una garantía extendida, estos tratamientos terminaron almacenados y sin uso adecuado, lo que se traduce en una pérdida económica estimada en 705 millones de pesos. Estos medicamentos podrían haber sido cruciales para tratar a algunos de los 334,336 fallecidos por COVID-19, según datos del gobierno en la página COVID-19 México.
Los medicamentos caducos se encuentran actualmente almacenados en las bodegas del Centro Nacional de Programas Preventivos y Control de Enfermedades, ubicadas en Arenal Tepepan, Tlalpan.
Este incidente, presuntamente, ocurrió debido a la falta de coordinación y la tardía recomendación de uso, ya que se olvidaron de distribuirlos en las unidades de salud y hospitales. Empezaron a recomendar su uso hasta diciembre de 2022, cuando se dieron cuenta de que los primeros lotes estaban a punto de caducar, señalaron fuentes del Instituto Mexicano del Seguro Social (IMSS). Esta situación ha generado gran controversia, ya que se está considerando la destrucción del medicamento debido a la falta de elementos científicos para justificar su uso.
Recientemente, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) autorizó la comercialización abierta de este medicamento, el primero para prevenir hospitalizaciones y disminuir la mortalidad por COVID-19. Esta autorización se fundamenta en la evaluación del Comité de Moléculas Nuevas (CMN) y el riguroso análisis técnico realizado por el equipo especializado de la agencia, quienes determinaron que el medicamento cumple con los requisitos de calidad, seguridad y eficacia, según la información presentada en el expediente técnico.

