EEUU aprueba tercera dosis Pfizer para mayores de 65 años

El miércoles por la noche, la FDA dio su postura sobre la aplicación de una tercera dosis de refuerzo del biológico de Pfizer, aprobando su uso en adultos mayores de 65 años.
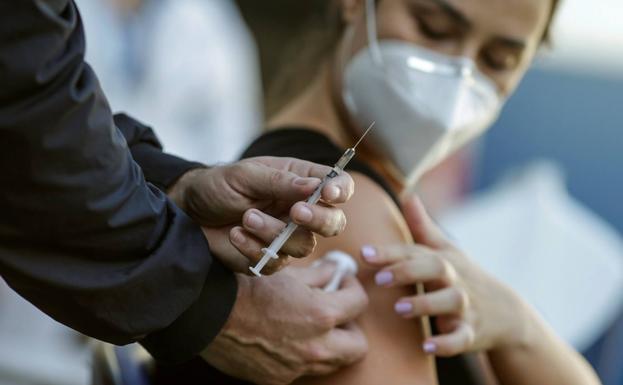
Durante la tarde-noche del miércoles, las autoridades sanitarias de Estados Unidos aprobaron la aplicación de una tercera dosis de la vacuna anti Covid-19 de la farmacéutica Pfizer en adultos mayores de 65 años, así como en personas con alto riesgo de padecer la enfermedad y las que se encuentran en entornos de alta exposición al virus.
A través de un comunicado emitido por Janet Woodcock, jefa en funciones de la Administración de Alimentos y Medicamentos (FDA), "La acción de hoy demuestra que la ciencia y los datos actualmente disponibles siguen guiando la toma de decisiones de la FDA para las vacunas contra el COVID-19 durante esta pandemia" aseguró la experta.
La determinación gubernamental llega en pleno debate sobre la necesidad de administrar una tercera dosis sobre la idoneidad de hacerlo mientras otros países aún no tienen suficientes vacunas; sin embargo, es fundamental ante la entrada del otoño y el próximo invierno con sus bajas temperaturas que aumentan los índices de enfermedades respiratorias.
Today, we amended the emergency use authorization (EUA) for the Pfizer-BioNTech COVID-19 Vaccine to allow for use of a single booster dose, to be administered at least 6 months after completion of the vaccine?s primary series in certain populations. https://t.co/xF8h0kmF61 pic.twitter.com/3dsIhM9MoV
— U.S. FDA (@US_FDA) September 22, 2021